Antecedentes
En las últimas cuatro décadas, la Agencia de Fármacos y Medicamentos (FDA) de los Estados Unidos de América, ha aprobado un total de 1881 fármacos, manteniendo en los primeros lugares la aprobación de fármacos sintéticos, fármacos derivados de productos naturales y biológicos.
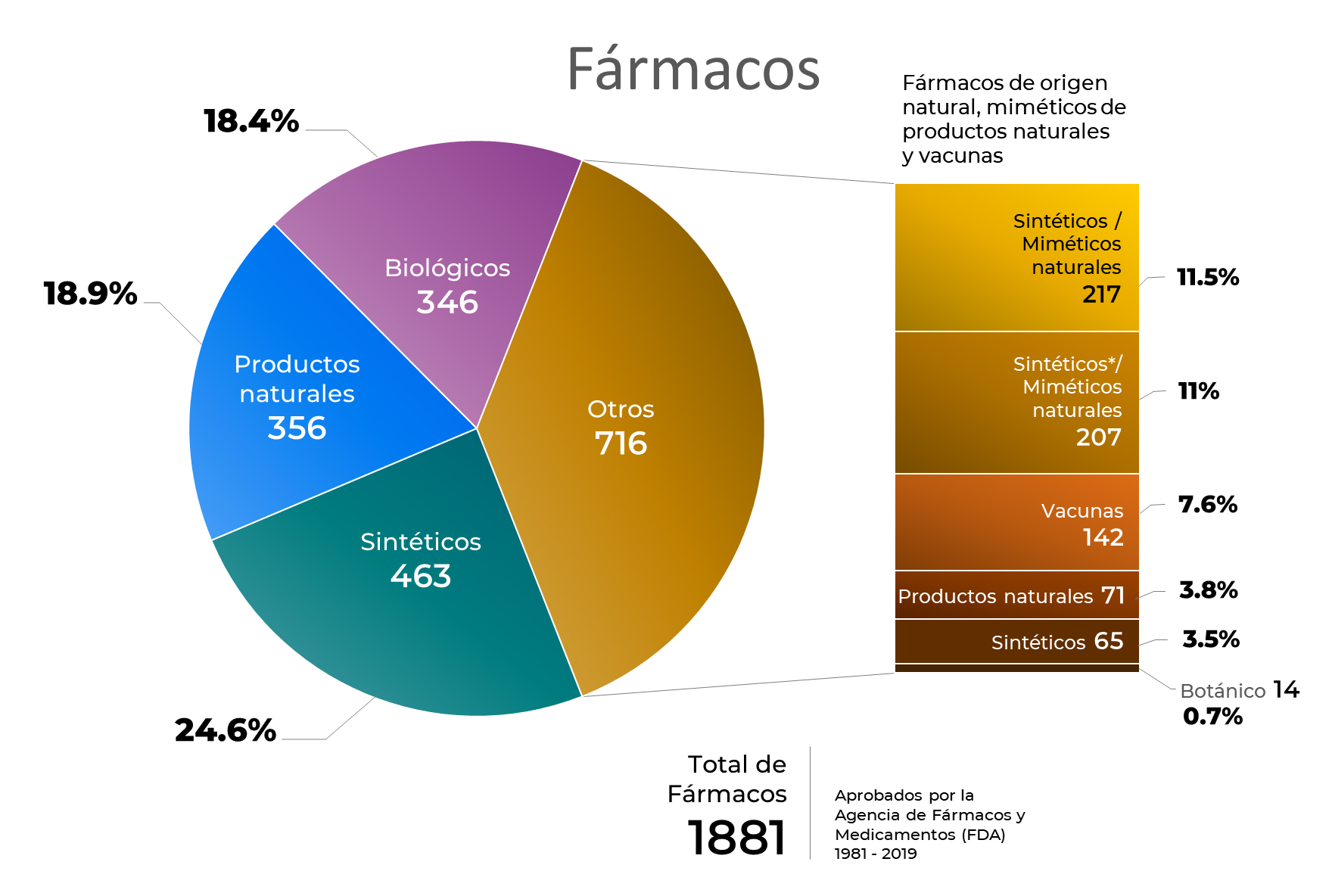
Los medicamentos biológicos pueden presentar un mayor grado de especificidad, siendo más eficaces y menos tóxicos. En esta categoría, los anticuerpos terapéuticos han surgido como alternativas terapéuticas de frontera. Aproximadamente, 79 anticuerpos monoclonales se han aprobado por la FDA y de éstos 30 se han autorizado para el tratamiento de diferentes tipos de cáncer (Lu, R. et. al. 2020).
A nivel nacional, el Cuadro Básico y Catálogo de Medicamentos tiene registrados 30 anticuerpos distribuidos en diferentes grupos de medicamentos, oncología (13), reumatología y traumatología (6), dermatología (2), endocrinología y metabolismo (2) y hematología (2) y uno en cada uno de los grupos denominados, enfermedades infecciosas y parasitarias, neurología, neumología y oftalmología (CSG, 2017). La dependencia tecnológica es la principal problemática en el desarrollo de estas inmunoterapias, debido a la infraestructura y estrategias articuladas que permitan para construir plataformas biotecnológicas, que faciliten el desarrollo anticuerpos terapéuticos y con ello disminuir los altos costos generados por el proceso de importación y que finalmente, convierten a estas terapias en costosas para el sistema de salud e inasequibles para los pacientes.
Lo anterior, planea la pertinencia de este proyecto cuyo objetivo es descubrir y desarrollar tres anticuerpos terapéuticos innovadores, anti- TNFα, anti-CD20 y anti-PD1.
Entregables
- Un anticuerpo terapéutico mexicano anti-TNFα avanzado al menos a la fase clínica 2.
- Un panel de anticuerpos específicos anti-CD20 y anti-PD1 validados en ensayos preclínicos para desarrollar líneas celulares estables y completar un dosier de aprobación para la Comisión Federal para la Protección contra riesgos Sanitarios (COFEPRIS).
REFERENCIAS
Valadon, P., Pérez-Tapia S.M., Nelson R.S., Guzmán-Brigas, O.U., Arrieta-Oliva H.I., Gómez-Castellano K.M., Phol M.A., Almagro JC., (2019). ALTHEA Gold Libraries antibody libraries for therapeutic antibody discovery. Mabs. 2019; 11(3):516-531.
https://pubmed.ncbi.nlm.nih.gov/30663541/
Lu, R. M., Hwang, Y. C., Liu, I.J. et. al. Development of therapeutic antibodies for the treatment of diseases, (2020). J Biomed Sci 27, 1. https://doi.org/10.1186/s12929-019-0592-z
Consejo de Salubridad General. Cuadro Básico y Catálogo de Medicamentos (2017). http://www.csg.gob.mx/contenidos/priorizacion/cuadro-basico/med/catalogos.html

Responsable
Dr. Juan Carlos Almagro Domínguez
Investigador
Escuela Nacional de Ciencias Biológicas (ENCB)
Instituto Politécnico Nacional
IPN