ALFREDO AGUILAR ELGUÉZABAL
Doctor en Ingeniería Química. Investigador del Centro de Investigación en Materiales Avanzados S.C., Centro Público de Investigación del Conacyt.

De forma majestuosa se pueden apreciar los tres estados del agua: las nubes que se formaron a partir de agua en estado gaseoso, el hielo de las montañas, que al pasar del estado sólido al líquido, dará cuerpo al lago, que en su fase líquida permitirá múltiples formas de vida. Xinantécatl, Nevado de Toluca, Estado de México, México. Fotografía de Alicia Mendoza Maldonado, 2017.
LA MOLÉCULA DEL AGUA Y SUS FASES
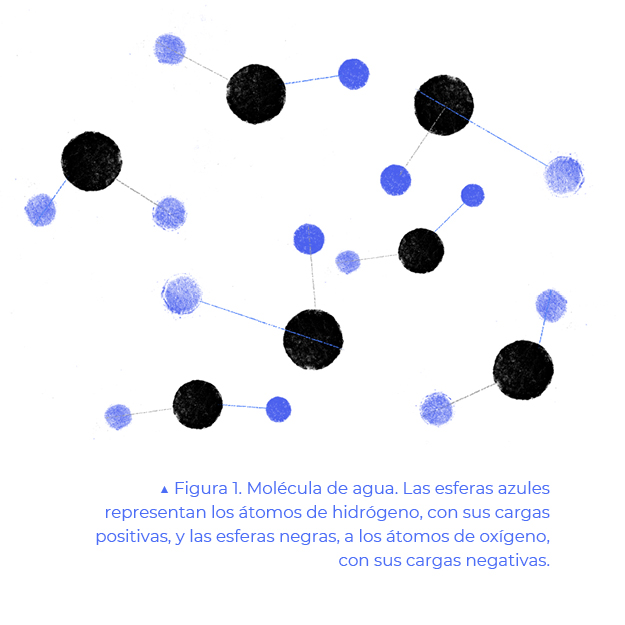
Cuando observamos una gota de agua, nuestros ojos sólo perciben un líquido transparente y no alcanzan a ver que está compuesto de moléculas, todas iguales, que se mueven caóticamente. Cada molécula de agua está formada por tres átomos: un átomo de oxígeno y dos de hidrógeno unidos a él.
El agua está presente en todo el universo. Diversos cuerpos celestes la tienen como principal componente: cometas de hielo que viajan por el espacio; lunas, como Titán, que tienen más agua que la Tierra; y, claro, planetas como el nuestro, donde el agua fluye armoniosamente en las tres formas en que la conocemos: sólida, líquida y gaseosa. La cantidad de agua en cada estado está determinada por la energía que recibe del Sol y nosotros tenemos la fortuna de estar a una distancia perfecta. De estar más lejos, el agua estaría permanentemente congelada y, de estar más cerca, el agua estaría continuamente en fase de vapor y, peor aún, saldría de la atmósfera para perderse en el espacio.
Los estados del agua dependen de la energía de las moléculas H₂O y de la fuerza que las mantiene unidas entre sí. Para imaginar esta fuerza, pensemos que la molécula es como un imán y que los hidrógenos tienen una carga positiva y el oxígeno una negativa. La carga positiva del hidrógeno es atraída por la carga negativa del oxígeno de la molécula más cercana. A esta atracción se le llama puente de hidrógeno.
AGUA EN FASE DE VAPOR
A nivel del mar, cuando se calienta el agua hasta llegar a 100 oC, la energía es suficiente para que las moléculas se liberen de la atracción de los puentes de hidrógeno. En este punto, las moléculas están tan separadas que se encuentran en la fase de gas o vapor y ocupan todo el volumen del recipiente en el que están. En los mares y lagos, la evaporación sucede a temperatura ambiente porque las moléculas de la superficie ganan suficiente energía para salirse de la fase líquida: la energía aportada por los rayos de sol, por el aire que está en contacto con el agua y por el agua que se encuentra bajo la superficie. Así, el agua de la superficie se evapora y asciende a la atmósfera, donde otra vez vuelve a la fase líquida, pero ahora en gotas tan pequeñas que pueden mantenerse suspendidas en el aire. Incluso, se enfría más hasta formar pequeños cristales de hielo. Estas partículas forman las nubes. Dependiendo de las condiciones atmosféricas, las partículas líquidas y sólidas pueden caer en forma de lluvia, nieve o granizo.
AGUA EN FASE LÍQUIDA
Que el agua sea líquida entre los 0 y los 100 ºC ha permitido a la naturaleza, a través de millones de años, experimentar para crear diferentes formas de vida. Para todas ellas este líquido vital desempeña un papel fundamental. Nuestro mundo tiene la mayor cantidad y diversidad de formas de vida allí donde el agua líquida está presente, pues ésta permite a los organismos vivos transportar nutrientes, generar energía, expulsar sus desechos, regular su temperatura, etc. En realidad, las funciones del agua para los seres vivos son interminables. Gran parte de sus habilidades se debe a la distribución de las dos cargas positivas (hidrógeno) y la negativa (oxígeno) que tiene cada molécula.
AGUA EN FASE SÓLIDA
El asombro por las propiedades extraordinarias del agua resalta en el estado sólido, es decir, cuando se encuentra en forma de hielo. Mientras que las sustancias convencionales se contraen al pasar al estado sólido, es decir, se hacen más compactas porque sus átomos se empaquetan mejor, el agua contradice a la naturaleza. Ésta se organiza en estado sólido de tal forma que los cristales que produce un grupo de moléculas ocupan más espacio que el que ocuparía el mismo grupo en forma líquida. Como resultado, el hielo flota en el agua líquida. Sin este pequeño detalle, el fondo de los ríos y lagos estaría congelado, por lo que los peces y otros seres vivos morirían sin remedio. La capa de hielo que cubre ríos y lagos en invierno actúa como aislante, permitiendo que la temperatura del agua bajo el hielo sea de unos 4 o C. Esto hace posible que los diversos residentes puedan seguir viviendo en su hábitat. Aún más, si el hielo no estuviera en la superficie, quizá el agua no alcanzaría a descongelarse en el verano.
¿UN NUEVO ESTADO DEL AGUA?
Recientes investigaciones científicashan descubierto otro estado del agua que se genera a temperaturas y presiones muy elevadas. A este estado se le conoce como hielo superiónico y se produce cuando, en un cristal, los átomos de hidrógeno dejan de estar unidos a los de oxígeno y forman una fase líquida que puede fluir entre la rígida estructura formada por los primeros. Este estado del agua es entonces dual, porque es a la vez sólido y líquido. La movilidad del hidrógeno permite que este hielo superiónico sea un buen conductor de electricidad. Este descubrimiento no sólo confirma que la molécula del agua es fascinante, sino también demuestra que todavía nos queda mucho por aprender sobre ella.